生物・環境
核小体の崩壊が細胞分裂のタイミングを遅延させる
筑波大学 生命環境系 木村圭志准教授、日本学術振興会特別研究員 林優樹博士らの研究グループは、公益財団法人がん研究会 がん研究所 実験病理部 広田 亨部長との共同研究により、リボソーム生合成の場である核小体の構造が細胞分裂の開始のタイミングを制御するメカニズムの一端を明らかにしました。
核小体の大きさは細胞の増殖状態を反映しており、増殖の盛んな細胞は巨大な核小体を有していることから、がんの悪性度を示す指標としても使われています。また、近年の研究の進展から、核小体がリボソームの組み立て以外にも、ストレス応答などの種々の細胞機能に関与することがわかってきました。例えば、DNA損傷などの種々のストレスに細胞がさらされた際には、核小体の崩壊が、がん抑制タンパク質を活性化することで細胞増殖の停止や細胞死を引き起こします。一方、細胞分裂の開始/終了に伴って核小体が解体/再構築されることから、核小体と細胞分裂の関連性が示唆されてきましたが、その実態はわかっていません。本研究では、二本鎖RNAを用いて特定の核小体タンパク質をノックダウンした際に、細胞分裂期を制御する酵素Cdk1キナーゼの活性化が抑制され、細胞分裂の開始が遅延することを見出しました。さらに、分裂間期での核小体の崩壊が、これらの細胞分裂期の異常の原因であることをつきとめました。
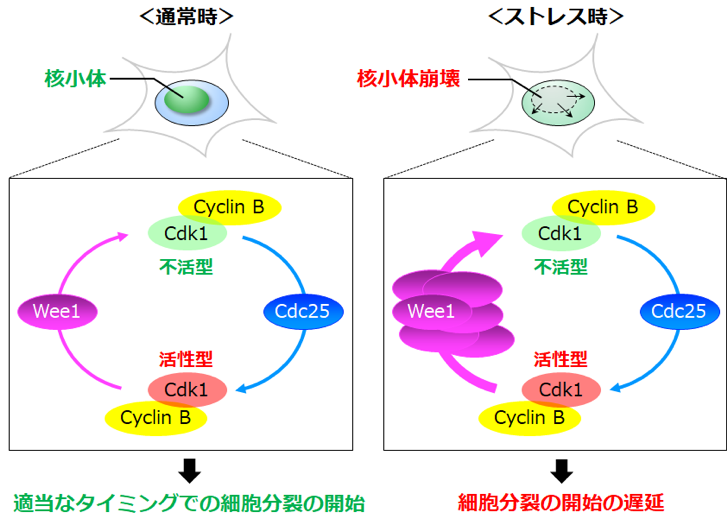
図 核小体崩壊によるM期の遅延
Cdk1キナーゼの活性は、Wee1キナーゼによるリン酸化で抑制され、それと拮抗するCdc25ホスファターゼによる脱リン酸化で活性化される。通常時は、Wee1キナーゼとCdc25ホスファターゼの絶妙なバランスにより、適切なタイミングで細胞はM期に進行する。細胞がストレスを受けた際にrRNAの転写が低下して核小体が崩壊すると、何らかのメカニズムでWee1キナーゼが蓄積してCdk1キナーゼの活性化が阻害され、M期の開始が遅延する。
核小体の大きさは細胞の増殖状態を反映しており、増殖の盛んな細胞は巨大な核小体を有していることから、がんの悪性度を示す指標としても使われています。また、近年の研究の進展から、核小体がリボソームの組み立て以外にも、ストレス応答などの種々の細胞機能に関与することがわかってきました。例えば、DNA損傷などの種々のストレスに細胞がさらされた際には、核小体の崩壊が、がん抑制タンパク質を活性化することで細胞増殖の停止や細胞死を引き起こします。一方、細胞分裂の開始/終了に伴って核小体が解体/再構築されることから、核小体と細胞分裂の関連性が示唆されてきましたが、その実態はわかっていません。本研究では、二本鎖RNAを用いて特定の核小体タンパク質をノックダウンした際に、細胞分裂期を制御する酵素Cdk1キナーゼの活性化が抑制され、細胞分裂の開始が遅延することを見出しました。さらに、分裂間期での核小体の崩壊が、これらの細胞分裂期の異常の原因であることをつきとめました。

図 核小体崩壊によるM期の遅延
Cdk1キナーゼの活性は、Wee1キナーゼによるリン酸化で抑制され、それと拮抗するCdc25ホスファターゼによる脱リン酸化で活性化される。通常時は、Wee1キナーゼとCdc25ホスファターゼの絶妙なバランスにより、適切なタイミングで細胞はM期に進行する。細胞がストレスを受けた際にrRNAの転写が低下して核小体が崩壊すると、何らかのメカニズムでWee1キナーゼが蓄積してCdk1キナーゼの活性化が阻害され、M期の開始が遅延する。
PDF資料
プレスリリースPREVIOUS
生物・環境
宍道湖、網走湖などの汽水湖でアオコが出現するメカニズムを解明
